Клинико–экономическая оценка инновационных лекарственных технологий при нейропатической боли

- Библиотека /
-
7800
Введение
Сегодня важным направлением исследований является экономическая оценка инновационных технологий лечения нейропатической боли, как патологии, требующей междисциплинарного подхода.
Нейропатической болью называется боль, которая вызывается повреждением или заболеванием нервной системы: периферической и центральной. Cегодня продолжается дискуссия о включении в определение синдрома нейропатической боли, помимо повреждения нервов, их дисфункции. Считают, что ключевым критерием для включения поражения нервной системы в этот синдром является нейрональная гипервозбудимость, так как лекарственные средства и немедикаментозные вмешательства, которые уменьшают эту гипервозбудимость, показали свою эффективность в лечении нейропатической боли [23]. Хроническая нейропатическая боль условно делится на периферическую (диабетическая полиневропатия, алкогольная полиневропатия, острая и хроническая воспалительная демиелинизирующая полиневропатия, алиментарно–обусловленные полиневропатии, идиопатическая сенсорная невропатия, компрессия или инфильтрация нерва опухолью, фантомные боли, постгерпетическая невралгия, тригеминальная невралгия, обусловленные ВИЧ сенсорные невропатии, туннельные невропатии, шейные радикулопатии, пояснично–крестцовые, боли после мастэктомии, пострадиационная плексопатия, комплексный регионарный болевой синдром) и центральную нейропатическую боль (компрессионная миелопатия при стенозе спинномозгового канала, пострадиационная миелопатия, сосудистая миелопатия, обусловленная ВИЧ миелопатия, травма спинного мозга, постинсультная боль, боль при рассеянном склерозе, боль при болезни Паркинсона, сирингомиелия, латеральный инсульт ствола мозга).
Истинные данные по распространенности нейропатической боли не представлены в отечественной и зарубежной медицинской литературе. Считается, что она встречается у 6–7 из 100 человек [1]. Распространенность нейропатической боли в популяции во Франции составляет 6,4%, в Германии – 6%, в Испании – 7,7% [6]. Интересными представляются результаты проспективного эпидемиологического исследования, проведенного в Великобритании на уровне первичного звена медицинской помощи, которое показало, что распространенность постгерпетической невралгии составила 40 случаев на 100 тыс. человек, тригеминальной невралгии – 27 случаев на 100 тыс. человек, фантомной лимбической боли – 1 случай на 100 тыс. человек, диабетической полинейропатии – 15 случаев на 100 тыс. человек. Лекарственные средства назначались пациентам с нейропатической болью в 46–66% случаев сразу после установления диагноза: антидепрессанты составили 30% от всех назначений, антиконвульсанты и наркотические анальгетики – по 20% от всех назначений соответственно [12]. В России представлены результаты когортного, скринингового двухэтапного эпидемиологического исследования распространенности нейропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к неврологу [2]. Согласно данному исследованию нейропатическая боль выявлена у 17,8% пациентов от всех обратившихся к врачу.
Разработка и внедрение новых лекарственных средств для терапии нейропатической боли должны учитывать экономию издержек (минимизация затрат), вопросы эффективности и оптимальности расходования средств (оценка затраты–эффективность). В настоящем обзоре представлена оценка новых средств лечения нейропатической боли с точки зрения их эффективности и экономичности, которая является синтезом международного и российского опыта по методологии выбора лекарственных средств данной группы на основе данных клинической медицины, фармации, эпидемиологии и экономики, результатов исследования качества жизни пациентов. Сегодня существуют такие методы оценки симптомов и качества жизни пациентов с нейропатической болью, как LANSS (Leeds Assessment of Neuropathic Symptoms and Signs), NPQ (Neuropathic Pain Questionnaire), DN4 (Douleur Neuropathique en 4 questions), painDETECT, ID–Pain [4]. Анализ лекарственных средств, рекомендованных для лечения нейропатической боли, основан на требованиях, предъявляемых к методам лечения в ОСТе «ПВБ. Общие положения»: действенность; эффективность; выборочность; терапевтическая ценность; безопасность; степень доступности; стоимость метода лечения с учетом капитальных затрат, прямых расходов и косвенных расходов; оценка стоимость/эффективность или иные фармакоэкономические расчеты. В обзоре анализ рекомендаций учитывал несколько уровней доказательств клинической эффективности и безопасности лекарственных средств. Убедительность доказательств оценивалась по шкале оценки доказательств.
Современные лекарственные средства для лечения нейропатической боли
Все лекарственные средства, применяющиеся для лечения нейропатической боли, можно разделить на классические и инновационные. Эффективность традиционных обезболивающих препаратов, например, нестероидных противовоспалительных препаратов в отношении нейропатической боли низкая. К классическим лекарственным средствам, применяющимся для лечения нейропатической боли, относятся противоэпилептические препараты и антидепрессанты, которые назначаются врачами в 13 и 8% случаев соответственно и характеризуются большим спектром неблагоприятных побочных реакций [1]. Более 60% больных с нейропатической болью получают неэффективную терапию, характеризующуюся низким уровнем безопасности.
Интенсивные поиски и исследования новых фармакологически значимых биологических мишеней являются одним из важнейших феноменов «постгеномной эры». Открытия в области расшифровки генома человека, интересные результаты протеомных исследований биологических жидкостей и тканей организма способствуют появлению новых терапевтических агентов для лечения многих заболеваний, и нейропатическая боль не является исключением.
Современное понимание механизмов формирования нейропатической боли формирует основные направления тактики лечения и включает несколько уровней: на молекулярном уровне – изменение функционирования рецепторов, клеточных каналов, нарушение молекулярных взаимодействий во внутриклеточном пространстве и изменения генетической экспрессии; на уровне органов – поражаются симпатические волокна, периферические нервные окончания, спинной мозг, головной мозг. Основными биомолекулами, которые принимают участие в возникновении периферической сенситизации, являются гистамин, норадреналин, брадикинин, простагландины, ионы водорода, ионы калия, пурины, цитокины, 5–гидрокситриптамин, лейкотриены, нейропептиды, факторы роста нервов. Ключевую роль в молекулярном патогенезе нейропатической боли играют нарушения нейрональной пластичности (рис. 1), в частности, потенциал–зависимые кальциевые и натриевые каналы, работа которых связана с активацией AMPA и NMDA–рецепторов. Они также определяют внутриклеточное распределение кальция и его участие в синтезе оксида азота, простагландинов, активации генов раннего реагирования (c–fos, c–jun) [21].
В настоящее время на фармацевтическом рынке России имеется единственный лекарственный препарат прегабалин (Лирика, Pfizer, США), механизм действия которого связан с воздействием на универсальную биомишень формирования нейропатической боли в центральной и периферической нервной системе – потенциал–зависимые кальциевые каналы [7,18].
Прегабалин является новой синтетической молекулой и структурным производным тормозного нейромедиатора – гамма–аминомасляной кислоты. Действенность активного вещества обусловлена связыванием с α2–δ субъединицей пресинаптического потенциал–зависимого кальциевого канала, в результате чего уменьшается высвобождение нескольких нейромедиаторов, включая глутамат, норадреналин, серотонин, допамин и субстанцию P в неокортексе, гиппокампе, миндалевидном теле [8,20]. Главное отличие механизма действия прегабалина от габапентина состоит в том, что аффинность прегабалина в отношении α2–δ субъединицы пресинаптического потенциал–зависимого кальциевого канала в 6 раз превышает аффинность габапентина в отношении данной биомишени [15]. Прегабалин инактивирует ГАМКа– и ГАМКв–рецепторы в центральной нервной системе [17]. Представленные звенья механизма действия прегабалина обеспечивают высокую действенность препарата в купировании и лечении нейропатической боли различного генеза, а также в терапии парциальных судорог, сопровождающихся или не сопровождающихся вторичной генерализацией, у взрослых.
Фармакокинетика прегабалина отличается от фармакокинетики габапентина, что обусловливает высокую эффективность и безопасность его применения у пациентов с нейропатической болью [5,24]. Отличительными фармакокинетическими характеристиками прегабалина являются линейный фармакокинетический профиль в зависимости от рекомендуемого диапазона доз (против нелинейного характера фармакокинетики габапентина), достижение пиковой концентрации в крови в течение 1 часа (против 3 часов у габапентина), достижение стабильной концентрации вещества в течение 24–48 часов, высокая биодоступность (90% против 33–66% у габапентина), период полувыведения до 6,7 часа, отсутствие метаболизма в печени и связывания с белками плазмы крови, выведение 98% вещества через почки, низкая вариабельность индивидуальных особенностей фармакокинетики (менее 20%), отсутствие фармакокинетических межлекарственных взаимодействий [3,5,22, 28]. Вышеперечисленные фармакокинетические особенности прегабалина обеспечивают быстрое наступление эффекта, высокую эффективность (в 2,5 раза выше) лекарственного средства у пациентов с нейропатической болью при более низких дозах, а также более высокий уровень безопасности прегабалина по сравнению с габапентином. Механизм действия и улучшенные фармакокинетические свойства прегабалина, составляющие основу высокой эффективности и безопасности лекарственного препарата, способствуют уменьшению общей продолжительности терапии нейропатической боли, периода нетрудоспособности, увеличению качества жизни пациента, снижению стоимости терапии заболевания и дополнительных затрат пациента на устранение неблагоприятных побочных эффектов при применении бензодиазепинов, миорелаксантов, противоэпилептических средств (карбамазепин, клоназепам, фенитоин, вальпроевая кислота, ламотриджин, топирамат), селективных ингибиторов обратного захвата серотонина, нестероидных противовоспалительных средств.
Анализ результатов клинических исследований эффективности и безопасности применения новых лекарственных средств для лечения нейропатической боли
Результаты клинических исследований показали невысокую эффективность опиоидов в лечении нейропатической боли в связи с развитием толерантности к этой группе лекарств и риском развития наркотической зависимости [16].
В клинических исследованиях показано, что трициклические антидепрессанты эффективно купируют болевой синдром при нейропатической боли [19]. Назначение этих препаратов ограничивается неблагоприятными побочными реакциями, связанными с антихолинергическим действием, ортостатической гипотензией и нарушениями ритма сердца.
Для лечения хронической нейропатической боли применяются противоэпилептические лекарственные средства, зарегистрированные в Российской Федерации (карбамазепин, ламотриджин, топирамат, леветирацетам) [27]. Назначение противоэпилептических лекарственных препаратов, в том числе препаратов второй генерации, при нейропатической боли ограничено отсутствием данных доказательной медицины об эффективности данной группы средств при синдроме нейропатической боли и наличием серьезных побочных реакций (гепатотоксичность, анемия, эндокринопатия, сонливость, слабость) [14].
Эффективность прегабалина как средства лечения нейропатической боли исследовалась в краткосрочных 6– и 12–недельных рандомизированных двойных слепых, плацебо–контролируемых, многоцентровых исследованиях у взрослых пациентов с диабетической периферической полинейропатией, постгерпетической невралгией, болью вследствие спинальной травмы, фибромиалгией, хронической постоперационной болью.
В открытом рандомизированном, двойном слепом, плацебо–контролируемом многоцентровом исследовании оценивалась эффективность прегабалина в фиксированной дозе для купирования нейропатической боли у 249 пациентов с диабетической периферической полинейропатией, а также в группе пациентов (89 человек) с постгерпетической невралгией [10]. Длительность исследования составила 12 недель. Пациенты были разделены на 2 группы: группа пациентов, получавших прегабалин с титрованием доз в диапазоне 150–600 мг/сут. с увеличением дозы в течение последних 8 недель до 457 мг/сут., и группа пациентов, получавших прегабалин в фиксированной дозе 600 мг/сут. Частота респондеров на проводимую терапию прегабалином составила 48,2% в группе пациентов, получавших титруемые дозы прегабалина, 52,3% в группе пациентов, получавших фиксированную дозу прегабалина, 24,2% в группе пациентов, получавших плацебо. В исследовании были зарегистрированы такие дозозависимые побочные реакции прегабалина, как сонливость, головокружение, а также периферические отеки.
Freeman R. с соавт. представили мета–анализ 7 рандомизированных плацебо–контролируемых исследований, в которых оценивалась эффективность и безопасность терапии прегабалином нейропатической боли у пациентов с диабетической периферической нейропатией [9]. В данных исследованиях предполагалось применение прегабалина у пациентов с диабетической периферической полинейропатией в дозах 150, 300 и 600 мг/сут. и интервалами дозирования (2 или 3 раза в сутки). Более высокие дозы обеспечивали более быстрое уменьшение симптомов нейропатической боли по сравнению с низкими дозами и плацебо. Наиболее быстрое уменьшение симптомов нейропатической боли наблюдалось при назначении прегабалина в дозе 600 мг/сут., разделенной на 2–3 приема.
В 2005 г. было выполнено специальное сравнительное исследование прегабалина и габапентина при болевой диабетической полиневропатии и постгерпетической невралгии. Авторы изучали эффективность прегабалина в суточной дозе 375 мг и габапентина в двух дозах 1200 мг/сут. и 1800 мг/сут. в группе пациентов (n=1000). Прегабалин был достоверно более эффективен, чем габапентин после 12–недельного курса лечения в отношении достижения конечных точек исследования – среднее количество дней без боли или с легкой болью (оценка боли по шкале <3 баллов) [26].
Оценка эффективности прегабалина в многоцентровых клинических исследованиях сопровождалась регистрацией и анализом неблагоприятных побочных реакций [11]. Прегабалин хорошо переносится, и дозозависимые побочные реакции являются обратимыми [13].
Приведенные выше данные доказательной медицины свидетельствуют о высокой эффективности и безопасности применения прегабалина в лечении нейропатического болевого синдрома.
Эффективность затрат при назначении новых лекарственных технологий для ведения пациентов с нейропатической болью
Клинико–экономический, в частности, фармакоэкономический анализ ведения пациентов с нейропатической болью способствует принятию важных решений на уровне пациента, врача, организаторов здравоохранения, касающихся выбора лекарственной технологии и метода ее исполнения. Фармакоэкономический анализ нейропатической боли позволяет представить годы жизни пациента с нейропатической болью, прожитые качественно (QALY), с точки зрения стоимости.
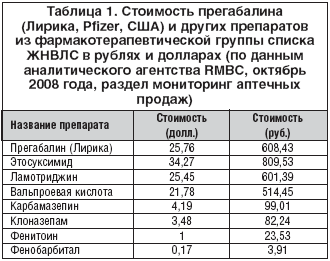
Сравнительные данные по стоимости прегабалина (Лирика, Pfizer, США) и других препаратов из той же фармакотерапевтической группы представлены в таблице 1. Эти данные позволяют предполагать, что наименьшие затраты по данным анализа минимизации затрат и с учетом затрат на устранение неблагоприятных побочных реакций прогнозируются в группах пациентов с нейропатической болью, которые будут принимать прегабалин.
Сегодня выполнено несколько клинико–экономических исследований для оценки среднезатратной эффективности применения новых лекарственных технологий при нейропатической боли. Наиболее интересным из них является Канадское проспективное исследование, включавшее анализ среднезатратной эффективности (сost–effectiveness analysis) и анализ затраты–полезность (cost–utility analysis) применения прегабалина для лечения нейропатической боли у пациентов с диабетической периферической нейропатией и постгерпетической невралгией [25]. В исследовании была использована модель Маркова, с помощью которой выполнена сравнительная оценка затрат и полезности применения 2 лекарственных технологий при нейропатической боли (габапентина и прегабалина) в течение 12 недель в гипотетической когорте пациентов с диабетической полинейропатией и постгерпетической невралгией (n=1000). Данные по эффективности терапии нейропатической боли основаны на результатах 3 клинических рандомизированных исследований, которые учитывали демографические данные, критерии включения пациентов в исследования и основные величины оценки боли. В рамках исследования сравнительная оценка лекарственных технологий ведения нейропатической боли проводилась на основе исследования качества жизни пациентов с помощью опросника EuroQol EQ–5D. Ожидаемые затраты на 1 пациента с диабетической полинейропатией при приеме габапентина составили 837,53 долларов Канады и 818,49 долларов Канады при приеме прегабалина. Фармакоэкономический анализ продемонстрировал, что показатель приращения затрат составил для прегабалина 31,148 и 20,101 долларов Канады для диабетической полинейропатии и постгерпетической невралгии соответственно. Авторы исследования сделали заключение о том, что прегабалин является наименее затратной и наиболее полезной технологией ведения пациентов с нейропатической болью в условиях диабетической полинейропатии и постгерпетической невралгии.
Таким образом, анализ действенности, эффективности и безопасности применения прегабалина (Лирика, Pfizer, США), затратной эффективности на модели Маркова, а также проведение инкрементального анализа инновационного лекарственного препарата у больных с нейропатической болью продемонстрировали, что применение препарата прегабалин (Лирика, Pfizer, США) в качестве средства первого ряда является предпочтительным, так как обеспечивает лучший контроль течения заболевания и является доступным по ценам для российского здравоохранения.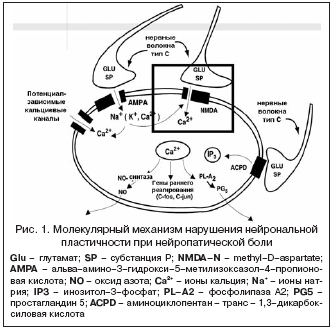
Литература
1. Данилов А.Б., Давыдов О.С. Эпидемиология невропатической боли //Боль. – 2007.– №4(17).– С. 11–15.
2. Яхно Н.Н., Кукушкин М.Л., Давыдов О.С., Данилов, А.Б., Амелин, А.В., Куликов, С.М. Результаты Российского эпидемиологического исследования распространенности невропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу–неврологу // Боль. – 2008. – № 3 (20). – С.24–32.
3. Ben–Menachem E. Pregabalin pharmacology and its relevance to clinical practice // Epilepsia. – 2004. – Vol. 45. – P.13–18.
4. Bennett M., Attal N., Backonja M., Baron R., Bouhassira D., Freynhagen R., Scholz J., Tolle Th., Wittchen H.–U., Jensen T. Using screening tools to identify neuropathic pain // Pain. – 2007. – № 127. – P. 199–203.
5. Bockbrader H., Hunt, T., Strand, J., Posvar, E., Sedman A. Pregabalin pharmacokinetics and safety in healthy volunteers: results from two phase 1 studies // Neurology. – 2000. – Vol.54. – P.421.
6. Breivik H., Collett, B., Ventafridda, V. et al. Survey of chronic pain in Europe: Prevalence, impact on daily life, and treatment // European Journal of Pain. – 2006. – V.10. – P.287–333.
7. Drug Enforcement Administration, Department of Justice. Schedules of controlled substances: placement of pregabalin into schedule V. // Final rule. Fed Regist. – 2005. – P.43633–43635.
8. Fehrenbacher J., Taylor, C., Vasko, M. Pregabalin and gabapentin reduce release of substance P and CGRP from rat spinal tissues only after inflammation or activation of protein kinase C // Pain. – 2003. – Vol.105. – №1–2. – P.133–141.
9. Freeman R., Durso–DeCruz, E., Emir, В. Efficacy, safety and tolerability of pregabalin treatment for painful diabetic peripheral neuropathy // Diabetes Care. – 2008. – Vol.31. – P.1448–1454.
10. Freynhagen R., Strojek, K., Griesing, T., Whalen, E., Balkenohl, M. Efficacy of pregabalin in neuropathic pain evaluated in a 12–week, randomised, double–blind, multicentre, placebo–controlled trial of flexible– and fixed–dose regimens // Pain. – 2005. – Vol. 115. – P.254–263.
11. Gajraj N. Pregabalin: Its Pharmacology and Use in Pain Management // Anesth. Analg. – 2007. – Vol.105. – P.1805–1815.
12. Hall G., Carroll, D., Parry, D., McQuay, H. Epidemiology and treatment of neuropathic pain: The UK primary care perspective // Pain. – 2006. –Vol. 122. – № 1. – P. 156–162.
13. Hindmarch I., Trick, L., Ridout F. A double–blind, placebo– and positive–internal–controlled (alprazolam) investigation of the cognitive and psychomotor profile of pregabalin in healthy volunteers // Psychopharmacology. – 2005. – Vol. 183. – P.133–143.
14. Ichiro I., Kentaro, H., Shun, H. Kyoji, K., Manami, I., Hiroaki, Y., Toshinobu, A. Pharmacoepidemiological study on adverse reactions of antiepileptic drugs // Chemical & Pharmaceutical bulletin. – 2008. –Vol.40. – №5. – P. 1280–1288.
15. Jones D, Sorkin, L. Systemic gabapentin and S(+)–3–isobutyl––aminobutyric acid block secondary hyperalgesia // Brain Res. – 1998. – Vol.810. – P.93–99.
16. Kathleen M. Opioids and chronic neuropathic // Pain. – 2003. –Vol. 348. – №13. – P.1279–1281.
17. Lanneau C., Green, A., Hirst, W., Wise, A., Brown, J., Donnier, E., Charles, K., Wood, M., Davies, C., Pangalos, M. Gabapentin is not a GABAB receptor agonist // Neuropharmacology. – 2001. – Vol. 41. – P.965–975.
18. Levien T. Summary of new drug applications and biologic license applications submitted to the Food and Drug Administration: Pregabalin–Pfizer // Advances in Pharmacy. – 2004. – Vol.2. – №2. – P.185–186.
19. McQuay H., Tramer, M., Nye, B., Carroll, D., Wiffen, P., Moore, R. A systematic review of antidepressants in neuropathic pain // Pain. – 1996. – Vol. 68. – № 2–3. – P.217–227.
20. Noor M. Pregabalin: its pharmacology and use in pain management // Anesth. Analg. – 2007. – Vol.105. – P.1805–1815.
21. Ollat H., Cesaro, C. // Clin. Neuropharmacology. – 1995. – Vol. 18. –P.391–404.
22. Randinitis E., Posvar E., Alvey, C., Sedman, A., Cook, J., Bockbrader, H. Pharmacokinetics of pregabalin in subjects with various degrees of renal function // J. Clin. Pharmacol. – 2003. – Vol.43. – P.277–283.
23. Scadding J. Neuropathic Pain // ACNR. – 2003. –Vol. 3. – № 2. – P.8–14.
24. Stewart B., Kugler, A., Thompson, P., Bockbrader, H. A saturable transport mechanism in the intestinal absorption of gabapentin is the underlying cause of the lack of proportionality between increasing dose and drug levels in plasma // Pharm. Res. – 1993. – Vol.10. – P.276–281.
25. Tarride J., Gordon, A., Vera–Llonch, M., Dukes, E., Rousseau, C. Cost–effectiveness of pregabalin for the management of neuropathic pain associated with diabetic peripheral neuropathy and postherpetic neuralgia: a Canadian perspective // Clinical Therapeutics. – 2006. – Vol. 28. – №11. – P.1922–1934.
26. Vera–Llonch M., Dukes, E., Argoff, C., Oster, G. Analgesic outcomes in patients with painful diabetic neuropathy or post–herpetic neuralgia receiving pregabalin versus gabapentin // 24th Annual scientific meeting of the American Pain Society. – 2005. – P.238.
27. Vinik A. Use of antiepileptic drugs in the treatment of chronic painful diabetic neuropathy // The Journal of Clinical Endocrinology & Metabolism. – 2005. – Vol. 90. – № 8. – P. 4936–4945.
28. Wesche D., Bockbrader, H. A pharmacokinetic comparison of pregabalin and gabapentin // Pain. – 2005. – Vol.6. – P.29.
.png)