Мерцательная аритмия на фоне сердечной недостаточности

- Библиотека /
-
8209
аМерцательная аритмия (МА) – одно из самых частых нарушений сердечного ритма. В клинической практике МА нередко сочетается с сердечной недостаточностью (СН), что обусловливает особый подход к ведению таких пациентов. Аритмии, в том числе МА, могут быть как самостоятельными факторами развития СН, так и утяжелять ее течение. В свою очередь, наличие СН дополнительно ухудшает гемодинамику, функцию левого желудочка (ЛЖ), способствует усугублению ишемии миокарда, его гипертрофии и ремоделированию. Поэтому сочетание МА и СН резко повышает общий сердечно-сосудистый риск, величина которого прямо пропорциональна тяжести СН. На Всемирном конгрессе кардиологов (Барселона, 2006) МА и СН называли двумя грозными эпидемиями, подпитывающими друг друга [6].
Однако, несмотря на высокую актуальность этих двух заболеваний, доказательная база, касающаяся ведения больных с сочетанием МА и СН, не столь уж велика, а в клинических рекомендациях таким пациентам также уделяется недостаточно внимания. Так, в руководстве ACC/AHA/ESC по ведению больных с МА (2006) различные аспекты лечения пациентов с СН затрагиваются лишь мельком [3]. Поэтому все публикации, посвященные этой сложной и многогранной проблеме, представляют особый интерес для практических врачей. Адекватное ведение МА на фоне СН способно существенно улучшить качество жизни пациентов и прогноз.
В связи с этим мы надеемся, что наш обзор по материалам статьи «Management of atrial fibrillation in patients with heart failure» (H.-R. Neuberger et al.), недавно опубликованной в авторитетном научном издании European Heart Journal (2007), станет не только предметом для дискуссий клиницистов на эту тему, но и полезным подспорьем для практических врачей. В статье обобщены последние литературные данные, касающиеся прогностического значения МА у больных СН, важности и оптимальных стратегий контроля ритма и частоты сердечных сокращений (ЧСС), а также возможностей профилактики МА у пациентов с дисфункцией желудочков.
Актуальность
МА и СН – две чрезвычайно важные сердечно-сосудистые проблемы. Хотя точная распространенность сочетания МА и СН остается неизвестной, по приблизительным оценкам, она составляет более чем 1% в общей популяции, увеличиваясь с возрастом [2, 6]. С учетом прогрессирующего старения населения планеты распространенность МА на фоне СН будет постоянно возрастать и может стать серьезной проблемой в ближайшем будущем. По данным ряда крупных исследований, МА встречается примерно у 10-15% всех больных СН II-III классов по NYHA (SOLVD, V-HeFT, CHF-STAT), 25-29% – при СН III-IV классов (DIAMOND CHF, GESICA); при тяжелой СН (IV класс) она имеется практически у каждого второго пациента (CONSENSUS) [1, 3]. Вместе с тем, по данным немецкого регистра AF-NET, СН выявляется примерно у трети всех больных с МА [6].
Такая тесная взаимосвязь между этими двумя патологиями обусловлена прежде всего тем, что как систолическая, так и диастолическая дисфункция ЛЖ ассоциированы с развитием МА, вызывая переполнение предсердий, их дилатацию, ишемию, локальный фиброз, ремоделирование миокарда и, как следствие, нарушения проводимости. В то же время аритмия может увеличивать ЧСС и способствовать развитию тахикардиомиопатии даже в нормальном миокарде, ухудшая его функциональные показатели и предрасполагая к СН. У большинства больных МА приводит к утяжелению недостаточности кровообращения за счет дополнительного снижения сердечного выброса на фоне неправильного ритма сокращений, а также появления митральной регургитации при нерегулярном ритме.
Таким образом, взаимосвязь между МА и СН напоминает порочный круг; соответственно МА у пациентов с СН является независимым фактором риска прогрессирующей дисфункции желудочков и усугубления симптомов СН (A.D. Krahn et al., 1995; U. Schotten et al., 2001; Y.M. Cha et al., 2004). МА может не только усугублять СН, но и изначально провоцировать ее развитие. В связи с этим МА впервые диагностируется у больных с предсуществующей СН столь же часто, как и СН у больных с предсуществующей МА, а в пятой части случаев такого сочетания оба патологических состояния выявляются одновременно (данные Фремингемского исследования).
МА и смертность больных СН
Вопрос о том, является ли МА независимым фактором риска дополнительного увеличения смертности пациентов с СН, на сегодняшний день остается дискутабельным. Одни исследования указывают на статистически значимое возрастание риска смерти при сочетании МА и СН (CHARM, SOLVD, VALIANT), другие не смогли обнаружить этой зависимости (VHeFT I и II, COMET).
В своей статье Neuberger H.-R. et al. [1] приводят некоторые данные, которые позволяют предполагать, что дополнительный риск зависит от тяжести СН и сохранности функции ЛЖ, а именно: чем тяжелее СН и ниже функция ЛЖ, тем меньше дополнительного риска может привнести МА. Вместе с тем эти данные тоже противоречивы. Так, в обзоре M.P. van den Berg et al. (2000) был сделан вывод о том, что наличие МА не увеличивает смертность на фоне тяжелой СН, но увеличивает ее у пациентов с нетяжелой и среднетяжелой СН.
В 2006 г. эти данные подтвердились крупным исследованием CHARM, в котором наличие МА ассоциировалось с возрастанием риска смерти от всех причин, причем у пациентов с более сохранной функцией ЛЖ дополнительный риск был выше. В исследовании W.G. Stevenson et al. (1996) выживаемость при сочетании МА и СН также была ниже, чем у лиц без аритмии. Однако в ранее проведенных испытаниях VHeFT I и II, включавших пациентов с нетяжелой СН, не было отмечено различий в смертности больных с МА и нормальным синусовым ритмом. В то время как при проспективном анализе H.J.G.M. Crijns et al. (2000) риск смерти пациентов с сочетанием МА и СН был повышен, после переоценки данных с учетом всех значимых прогностических факторов эти различия исчезли. Аналогичные результаты получены в исследовании COMET, в котором первоначально выявленное влияние МА на смертность пациентов исчезло после мультивариантного анализа.
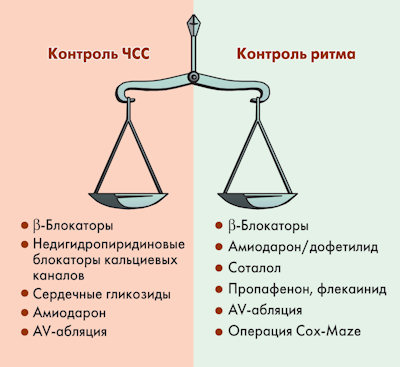
Что важнее контролировать: ритм или ЧСС?
Ответ на этот вопрос не столь однозначен, как может показаться. Теоретические предпосылки позволяют предполагать, что, поскольку аритмия усугубляет течение СН, повышает риск тромбоэмболических осложнений и ухудшает прогноз, то контроль ритма (то есть восстановление и поддержание синусового ритма) улучшит клиническое состояние пациента, уменьшит смертность и риск осложнений. Однако нет убедительных доказательных данных, подтверждающих это.
С 2000 г. было проведено пять исследований, в которых сравнивали стратегии контроля ритма и контроля ЧСС (PIAF, STAF, RACE, AFFIRM, HOT-CAFE). Контроль ритма в этих исследованиях осуществлялся антиаритмиками I или III класса (STAF, RACE, AFFIRM), соталолом или антиаритмиками I класса (HOT-CAFE), амиодароном (PIAF); контроль ЧСС – β-адреноблокаторами, недигидропиридиновыми блокаторами кальциевых каналов, дигоксином (STAF, RACE, AFFIRM, HOT-CAFE), абляцией атриовентрикулярного узла и дополнительных путей проведения (STAF), дилтиаземом (PIAF). Результаты этих исследований не показали приоритетность контроля ритма.
Так, в наиболее крупном из этих испытаний – AFFIRM (2004) – исходы в группах контроля ритма и контроля ЧСС были сравнимы, к тому же в группе контроля ЧСС имела место тенденция к снижению смертности. В исследовании RACE (2005) контроль ритма также не был приоритетным, хотя в группе контроля ЧСС отмечена тенденция к повышению смертности и серьезных геморрагических осложнений, а контроль ритма (при условии, что синусовый ритм хорошо поддерживался) ассоциировался с отличной выживаемостью. Кроме того, в уже упомянутом исследовании AFFIRM синусовый ритм также обусловливал значительное снижение смертности. Авторы статьи также приводят результаты одного из субисследований DIAMOND, в котором возобновление синусового ритма у пациентов с МА и фракцией выброса ЛЖ 35% сопровождалось существенным уменьшением смертности.
На основании этих данных авторы [1] все же делают вывод, что синусовый ритм можно считать причиной или по крайней мере маркером лучшего прогноза. В настоящее время проводится первое проспективное исследование по сравнению контроля ритма и контроля ЧСС у пациентов с СН – AF-CHF (Atrial Fibrillation and Congestive Heart Failure) [8]. Возможно, оно расставит точки над «i» в этом вопросе.
Добавим, что на сегодняшний день за неимением четкой доказательной базы многие специалисты придерживаются мнения, что у пациентов с тяжелыми гемодинамическими нарушениями в связи с сочетанием МА и СН нужно в первую очередь поддерживать синусовый ритм. В том же случае, когда МА на фоне СН не приводит к выраженным симптомам ухудшения, может быть оправдана стратегия контроля ЧСС в комплексе с применением препаратов, снижающих возбудимость атриовентрикулярного узла [6, 8]. Однако пока нет оснований утверждать, что контроль ритма – оптимальная стратегия лечения больных с МА на фоне СН. Существует другая точка зрения: контроль ритма рационально проводить только в том случае, если после использования методов контроля ЧСС состояние пациента существенно не улучшилось [7].
Подробнее о контроле ЧСС
Как уже было отмечено, существуют доказательные данные, которые указывают на важность контроля ЧСС при сочетании МА и СН. Однако пока сложно сказать, какой уровень ЧСС следует считать оптимальным. Так, ученые не обнаружили различий между относительно мягким контролем ЧСС в исследовании RACE (до 100 уд/мин в покое) и более жестким – в исследовании AFFIRM (до 80 уд/мин в покое и до 110 уд/мин после физической нагрузки). Кроме того, результаты небольшого обсервационного исследования M. Rienstra et al. (2006) показали, что снижение ЧСС ниже 80 уд/мин может обусловливать худший прогноз у пациентов с МА и тяжелой СН.
С клинической точки зрения, подчеркивают авторы статьи [1], не следует возлагать особые надежды на уровень ЧСС в покое; более показательными для оценки контроля ЧСС являются обследование после физической нагрузки (тредмил-тест) и суточное холтеровское мониторирование, то есть определение толерантности к физической нагрузке и стабильности ЧСС на протяжении суток. Именно с этих позиций проблема контроля ритма будет изучаться в исследовании RACE-II.
В настоящее время для контроля ЧСС используются следующие стратегии: назначение β-блокаторов, недигидропиридиновых блокаторов кальциевых каналов, сердечных гликозидов, амиодарона, абляция атриовентрикулярного узла и дополнительных путей проведения. Несмотря на достаточный выбор возможных стратегий, антиаритмическая терапия при СН на самом деле представляет большие трудности, что связано с отрицательным инотропным действием многих антиаритмических средств. Кроме того, на фоне выраженной дисфункции ЛЖ (фракция выброса < 30-35%) некоторые препараты оказывают аритмогенное действие, включая опасную полиморфную желудочковую тахикардию типа «torsade de pointes» (пируэт-тахикардию).
β-Блокаторы рекомендуются для контроля ЧСС при сочетании СН и МА руководством ACC/AHA/ESC по ведению МА (2006), а также руководствами ACC/AHA и ESC по ведению СН (2005) [3-5]. Именно эти препараты показали наибольшую эффективность по результатам исследования AFFIRM. Однако следует помнить об отрицательном инотропном эффекте β-блокаторов и, следовательно, назначать их при СН с осторожностью, особенно если речь идет о внутривенном способе введения. К сожалению, на сегодня существует только одно проспективное двойное слепое плацебо-контролируемое исследование, целенаправленно изучавшее эффективность β-блокаторов у пациентов с МА и СН (A.U. Khand et al., 2003), в котором принимали участие всего 47 пациентов. Согласно его результатам, добавление карведилола к дигоксину способствовало увеличению фракции выброса ЛЖ и обеспечивало хороший контроль ЧСС. Однако срок наблюдения в этом исследовании был небольшим и смертность пациентов не изучалась.
Некоторые полезные сведения можно почерпнуть из более крупных исследований, в которых участвовали пациенты с сочетанием МА и СН. Ретроспективный анализ результатов программы изучения карведилола при СН у пациентов из США (J.A. Joglar et al., 2001) показал, что у больных с МА на фоне СН прием карведилола статистически значимо улучшал фракцию выброса ЛЖ – с 23 до 33%, тогда как в группе плацебо – с 24 до 27%. Кроме того, у таких пациентов отмечалась тенденция к уменьшению комбинированной первичной точки (смерть + госпитализация по поводу усугубления СН). В другом крупном исследовании – MERIT-HF (2000) – метопролол способствовал значительному снижению риска смерти и необходимости трансплантации сердца у пациентов с СН II-IV классов по NYHA. Однако, выделив из этих пациентов подгруппу с МА, ученые, к своему удивлению, обнаружили, что β-блокатор у этих больных не оказал никакого эффекта на общую или кардиоваскулярную смертность. Точно так же бисопролол не оказал значимого эффекта на выживаемость пациентов с тяжелой СН и МА в исследовании CIBIS-II (2001). Авторы объясняют это слишком резким снижением артериального давления на фоне приема бисопролола, что нивелировало положительный эффект восстановления синусового ритма.
Недигидропиридиновые блокаторы кальциевых каналов также отличаются отрицательным инотропным эффектом, потому обычно редко применяются при СН. Однако известны несколько небольших исследований, в которых было показано, что непродолжительное применение дилтиазема при МА на фоне умеренной и тяжелой СН может быть эффективным и безопасным (I.F. Goldenberg et al., 1994; J.T. Heywood, 1995; K.G. Delle et al., 2001).
Сердечные гликозиды (дигоксин), равно как и β-блокаторы, рекомендуются для контроля ЧСС при сочетании МА и СН руководством ACC/AHA/ESC по ведению МА (2006), а также руководствами ACC/AHA и ESC по ведению СН (2005) [3-5]. Однако следует помнить о следующей особенности механизма действия дигоксина: он увеличивает тонус парасимпатической системы (в частности, блуждающего нерва), потому наиболее эффективно контролирует ЧСС в покое, но во время физической нагрузки или в связи с любой другой причиной повышения тонуса симпатической нервной системы не способствует хорошему удержанию ЧСС. Этим, скорее всего, объясняются лучшие результаты (более строгий контроль ЧСС, более выраженное уменьшение симптоматики, улучшение функции желудочков) при комбинировании дигоксина с β-блокатором в уже упомянутом небольшом исследовании A.U. Khand et al. (2003), по сравнению с монотерапией дигоксином. Подобная закономерность прослеживается и в AFFIRM, где адекватного контроля ЧСС как в покое, так и после физической нагрузки достигли всего 54% пациентов, получавших только дигоксин, и 81% больных, принимавших β-блокатор с/без дигоксина.
Авторы статьи [1] подчеркивают, что за неимением доказательств преимуществ конкретной тактики оптимальным вариантом на сегодняшний день следует считать комбинацию дигоксина и β-блокатора, поскольку такое сочетание требует меньших доз обоих препаратов и, оставаясь достаточно активным по отношению к контролю ЧСС, реже приводит к побочным эффектам.
Влияние сердечных гликозидов на выживаемость больных с МА и СН остается неизвестным.
Амиодарон, согласно уже упомянутым клиническим руководствам [3-5], считается препаратом второй линии для контроля ЧСС при сочетании МА и СН. Хотя амиодарон более эффективен, чем дигоксин, его длительное применение чаще сопровождается развитием побочных эффектов, поэтому амиодарон обычно используется в качестве внутривенного болюса для быстрого восстановления нормальной ЧСС, прежде всего при критических состояниях, у тяжелых пациентов.
Абляция (катетерная радиочастотная деструкция) атриовентрикулярного узла и дополнительных путей проведения – весьма эффективный метод продолжительного (пожизненного) и хорошего контроля ЧСС. Однако проведение такого вмешательства обрекает пациента на постоянную зависимость от искусственного водителя ритма, поэтому к нему стоит прибегать только в том случае, если неинвазивные подходы потерпели фиаско. Кроме того, ввиду вероятности развития гемодинамических осложнений при постоянной правожелудочковой электрокардиостимуляции следует тщательно взвесить выбор конкретной стратегии этой операции при СН. При тяжелой СН (низкой фракции выброса, высокой степени митральной регургитации) высок риск развития межжелудочкового асинхронизма, поэтому чаще всего таким больным обеспечивают не правожелудочковую, а бивентрикулярную или левожелудочковую электрокардиостимуляцию. Авторы статьи [1] приводят данные ряда исследований, посвященных изучению оптимальной стратегии (E. Occhetta et al., 2006; OPSITE, 2005; PAVE, 2005).Интересно, что хотя абляция атриовентрикулярного узла и дополнительных путей проведения улучшает и клиническое состояние пациента, и качество его жизни, положительного влияния на выживаемость больных после этой процедуры обнаружить пока не удалось (M.A. Wood et al., 2000; C. Ozcan et al., 2001).
Возможно проведение модификации атриовентрикулярного узла, которая обеспечивает замедление сердечного ритма, но, в отличие от полной элиминации атриовентрикулярного узла, не требует установки электрокардиостимулятора. Однако эта процедура технически сложнее, и во время ее проведения порой сложно предотвратить полную элиминацию узла, то есть абляцию. Кроме того, даже при успешно выполненной модификации нормализация ЧСС не гарантирована. В связи с этим данная методика в клинической практике используется достаточно редко.
Изучаются также подходы, связанные с клеточной терапией, которые в перспективе могут изменить атриовентрикулярную проводимость. Но пока соответствующие испытания со стволовыми клетками находятся на доклиническом этапе.
Проблема поддержания синусового ритма после кардиоверсии
С этой целью также могут использоваться различные фармакологические и инвазивные подходы: β-блокаторы, амиодарон, дофетилид, соталол, антиаритмические препараты I класса, катетерная абляция, хирургические вмешательства.
β-Блокаторы как средства контроля сердечного ритма после кардиоверсии на фоне СН специально не изучались, поэтому имеющаяся доказательная база основана на косвенных данных. Так, известно, что достаточно длительное применение β-блокаторов при СН способствует уменьшению нагрузки на предсердия и препятствует ремоделированию миокарда предсердий, тем самым улучшая структуру и функцию предсердий и снижая риск предсердных аритмий (как новых, так и рецидивных). В исследовании COPERNICUS (2002) карведилол сравнивали с плацебо, в том числе и у небольшой группы пациентов с МА.
Как оказалось, риск развития рецидива МА был ниже в группе карведилола почти в два раза, хотя, разумеется, в силу малого числа больных эти данные не были статистически значимыми. Существенное снижение риска рецидива МА на фоне приема карведилола продемонстрировано и по результатам post hoc анализа исследования CAPRICORN (2005). Однако наиболее убедительные данные были получены благодаря ретроспективному анализу результатов исследования MERIT-HF, показавшего почти двукратное снижение риска новых случаев МА у пациентов с СН II-IV классов по NYHA.
Однако в настоящее время единственными рекомендованными руководством ACC/AHA/ESC по ведению МА (2006) и руководствами ACC/AHA и ESC по ведению СН (2005) [3-5] антиаритмическими средствами для контроля сердечного ритма у пациентов с МА и СН остаются амиодарон и дофетилид.
В исследовании DIAMOND дофетилид доказал свою эффективность в восстановлении и поддержке синусового ритма. При этом дофетилид относительно безопасен: он не имеет отрицательного инотропного эффекта и не влияет на смертность пациентов. Очевидным недостатком этого препарата является очень узкое терапевтическое окно: у части пациентов, принимающих дофетилид, может развиться осложнение в виде «torsade de pointes». Вероятность этого осложнения можно уменьшить, корректируя дозу в зависимости от почечной функции и осуществляя тщательный мониторинг сердечной деятельности первые 3 сут лечения. К сожалению, дофетилид на сегодняшний день зарегистрирован только в США и пока недоступен ни в Европе, ни в странах СНГ.
Амиодарон – также достаточно эффективный и безопасный препарат для восстановления и поддержания синусового ритма при МА, в том числе на фоне СН. Это подтверждается прежде всего результатами исследования CHF-STAT (1998), в котором применение амиодарона позволило восстановить синусовый ритм у части пациентов с МА и предупредить предсердные нарушения ритма при дальнейшем приеме препарата. При этом следует учитывать его возможные побочные эффекты, среди которых наиболее существенным является брадикардия; именно она ограничивает рутинное назначение амиодарона на продолжительный срок.
Соталол по сути является β-адреноблокатором, однако занимает среди них особое место в связи с тем, что он также обусловливает удлинение реполяризации за счет блокирования калиевых каналов, подобно противоаритмическим препаратам III класса. Однако результаты исследования SWORD (1996) свидетельствуют, что этот эффект соталола ассоциирован с увеличением смертности у пациентов с тяжелой желудочковой дисфункцией после перенесенного инфаркта миокарда. Ретроспективный метаанализ, включивший 22 клинических исследования с общим числом пациентов более 3 тыс. (M.H. Lehmann et al., 1996), показал, что наличие СН ассоциировано с повышенным риском развития «torsade de pointes» на фоне приема соталола. С учетом вышеизложенного следует избегать применения этого препарата у больных СН.
Антиаритмические препараты I класса (пропафенон, флекаинид) также не должны использоваться при СН в связи с отрицательным инотропным эффектом и потенциальными серьезными проаритмическими свойствами. В ретроспективном анализе исследования SPAF применение этих препаратов было ассоциировано с повышением смертности у пациентов с СН.
Катетерная абляция, согласно действующим клиническим руководствам, рассматривается как разумная альтернатива фармакотерапии, при условии, что левое предсердие нормальных размеров или незначительно увеличено. Однако доказательная база относительно использования этого метода у пациентов с МА и СН, ограничена. В 2004 г. опубликована статья L.F. Hsu et al., в которой были представлены результаты исследования по применению катетерной абляции у 58 пациентов с МА на фоне СН (фракция выброса ЛЖ – 45%) в одном из центров с большим опытом проведения подобных операций. По данным авторов исследования, такой подход существенно улучшает работу сердца, повышает переносимость физической нагрузки, уменьшает симптоматику заболевания, улучшает качество жизни даже у больных СН. Однако в исследовании не было контрольной группы, а продолжительность наблюдения за пациентами составила всего 12 мес, поэтому на сегодняшний день ввиду сложности выполнения этой процедуры и недостаточности доказательной базы катетерная абляция не рекомендуется для рутинной практики.
Хирургические вмешательства при МА могут выполняться в виде так называемой процедуры Cox-Maze («лабиринт»), которая позволяет уменьшить массу миокарда предсердия и одновременно воздействовать на аритмию. Механизм эффективности этой процедуры еще до конца не изучен, но предполагается, что лабиринтообразные разрезы с последующим ушиванием уменьшают объем предсердия, а также препятствуют распространению макро re-entry. По данным изобретателя этой техники J.L. Cox (1996), после такого вмешательства у 90% пациентов происходит восстановление синусового ритма без использования дополнительных противоаритмических средств. Эффективность и безопасность Cox-Maze у больных СН не изучалась в проспективных исследованиях, но, по результатам одного небольшого ретроспективного исследования (J.M. Stulak et al., 2006), проведение вмешательства у больных с систолической дисфункцией положительно сказывалось и на функции ЛЖ, и на общем функциональном статусе пациентов. Проведение такой операции в настоящее время рекомендуется у отдельных пациентов, которым также требуется какое-нибудь другое сердечно-сосудистое вмешательство (операция на клапанах, аортокоронарное шунтирование).
Особенности лечения СН при наличии МА
Необходимо учитывать определенные нюансы ведения пациентов с СН на фоне МА, а также принимать во внимание влияние различных лекарственных препаратов на риск развития кардиальной аритмии при СН.
Так, при СН рекомендованы блокаторы ренин-ангиотензин-альдостероновой системы – ингибиторы ангиотензинпревращающего фермента (АПФ), блокаторы рецепторов ангиотензина II, антагонисты альдостерона, убедительно доказавшие свою эффективность в клинических исследованиях (CONSENSUS, SOLVD-T, Val-HeFT, CHARM, RALES, EPHESUS). В экспериментальной модели также было показано, что ингибитор АПФ эналаприл влияет на предсердную проводимость, фиброз миокарда предсердий, а также на среднюю продолжительность эпизодов индуцированной МА (D. Li et al., 2001). Ретроспективный анализ исследований TRACE и SOLVD позволил убедиться в том, что применение ингибиторов АПФ в клинической практике снижает риск развития МА у пациентов с дисфункцией ЛЖ. Кроме того, по данным A.H. Madrid et al. (2002) и K.C. Ueng et al. (2003), ирбесартана и эналаприл могут уменьшать риск рецидива МА после кардиоверсии. В дополнение к этому авторами статьи [1] инициировано исследование, посвященное изучению потенциальной возможности блокатора альдостерона – эплеренона – предупреждать рецидив МА после кардиоверсии у больных СН.
Диуретики также относятся к препаратам базисной терапии при СН и дисфункции ЛЖ. Известно, что они могут уменьшать размеры дилатированных предсердий: так, в исследовании J.S. Gottdiener et al. (1998), в котором сравнивали эффект различных антигипертензивных препаратов (атенолола, каптоприла, хлонидина, дилтиазема, гидрохлортиазида, празозина) относительно уменьшения размеров левого предсердия, гидрохлортиазид показал наилучшие результаты. Это позволяет предполагать положительное влияние диуретиков на функцию проводимости в миокарде. Однако этот вопрос еще предстоит изучить, особенно относительно больных с СН. В исследовании W. Anne et al. (2004) прием диуретиков ассоциировался с меньшим риском рецидива МА после катетерной радиоабляции атриовентрикулярного узла, но следует учитывать, что практически у всех пациентов систолическая функция была нормальной, так что реальное влияние диуретиков на профилактику МА у больных СН остается неизвестным.
Бивентрикулярная электрокардиостимуляция (кардиоресинхронизация) показана пациентам с кардиальной диссинхронией, которая развивается на фоне тяжелой СН. В нескольких исследованиях последних лет установлено, что эта методика может быть полезной также у больных с МА, включая пациентов после проведенной абляции атриовентрикулярного узла. Но данные по этому поводу несколько противоречивы. В одном из исследований (CARE-CHF) кардиоресинхронизация не способствовала уменьшению риска развития новых случаев МА, хотя и улучшала исходы, а в исследовании B. Hugl et al. (2006) – снижала риск развития МА. Влияние этой методики на выживаемость больных с МА и СН еще предстоит выяснить.
Заключение
Таким образом, в настоящее время проблема сочетания МА и СН, несмотря на высокую актуальность, остается малоизученной. Неизвестно, является ли МА независимым фактором риска или только маркером увеличивающейся смертности у пациентов с СН. Не доказано, какая стратегия представляется приоритетной для таких больных – контроль ЧСС или контроль ритма. Недостаточно доказательных данных по оптимальному медикаментозному и инвазивному лечению пациентов с МА на фоне СН, также предстоит подробно исследовать влияние различных подходов к лечению СН на риск развития (рецидива) МА и общий прогноз. Проблема сочетания МА и СН является частным случаем огромной и сложнейшей проблемы сердечной недостаточности, однако требует особого внимания.
Хотелось бы обратить внимание клиницистов, что в статье [1] не упоминалась такая важная группа препаратов, как статины. Необходимо добавить, что существует также несколько исследований последних лет, в которых статины демонстрируют определенную эффективность в отношении МА на фоне СН. Так, вызывает интерес недавнее крупное обсервационное исследование A. Selcuk Adabag et al. (Am Heart J 2007; 154: 1140-1145), в котором было показано, что статины на 43% уменьшают риск развития МА у больных ишемической болезнью сердца на фоне застойной СН. Следует особо подчеркнуть, что такой эффект был получен только в подгруппе СН, а в целом статины не влияли на риск аритмий во всей когорте пациентов с ишемической болезнью сердца. Разумеется, эти данные должны быть подтверждены в рандомизированных клинических исследованиях. Еще ранее, в мае 2005 г., на ежегодной научной сессии Американского общества сердечного ритма сообщалось о способности статинов снижать риск развития МА при СН в связи с результатами многоцентрового сравнительного проспективного наблюдения ADVANCENT.
Кроме того, в статье не был затронут вопрос антикоагулянтной терапии. Без сомнений, антикоагулянты являются одной из основных групп препаратов, показанных при сочетании МА и СН. В руководстве ACC/AHA/ESC по ведению больных с МА [3] варфарин рекомендуется в том числе и при СН, а также при фракции выброса ЛЖ ниже 35%.
Литература:
1. Neuberger H.-R., Mewis C., J. van Veldhuisen D. et al. Management of atrial fibrillation in patients with heart failure. European Heart Journal 2007; 28 (21): 2568-2577.
2. Rosamond W. et al. Heart Disease and Stroke Statistics – 2008 Update. A Report From the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2008; 117: e25-e146.
3. Fuster V. et al. ACC/AHA/ESC 2006 Guidelines for the Management of Patients With Atrial Fibrillation. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients With Atrial Fibrillation). Developed in Collaboration With the European Heart Rhythm Association and the Heart Rhythm Society. JACC 2006; 4 (48): e149-246
4. Hunt S.A. ACC/AHA 2005 guideline update for the diagnosis management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation Management of Heart Failure). J Am Coll Cardiol 2005; 46: e1-e82.
5. Swedberg K. et al. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005): The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur Heart J 2005; 26: 1115-1140.
6. Материалы Всемирного конгресса кардиологов (Барселона, 2006): http://www.escardio.org.
7. Schuchert A. Atrial fibrillation and heart failure comorbidity. Minerva Cardioangiol 2005; 53 (4): 299-311.
8. Roy D. Rationale for the Atrial Fibrillation and Congestive Heart Failure (AF-CHF) trial. Card Electrophysiol Rev 2003; 7 (3): 208-10.
Обзор статьи H.-R. Neuberger, C. Mewis, D.J. van Veldhuisen, U. Schotten, I.C. van Gelder, M.A. Allessie and M. Bohm. Management of atrial fibrillation in patients with heart failure. European Heart Journal 2007; 28 (21): 2568-2577
Источник: Medicine Review 2008; 1 (01): 48-54
.png)