Совершенствование процедуры комплексной оценки лекарственных препаратов для включения в систему государственного финансирования

- Новости /
-
2347
В рамках совершенствования процедуры включения лекарственных препаратов в перечни, финансируемые из средств государственного бюджета (ограничительные перечни) рабочей группой по мониторингу правоприменительной практики Правил формирования перечней лекарственных препаратов Минздрава России разрабатываются поправки к Постановлению Правительства Российской Федерации от 28 августа 2014 г №871 «Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи».
Включение новых препаратов в перечни требует тщательного анализа последствий их применения для здоровья пациентов и нагрузки на систему здравоохранения. В текущей практике включения лекарственных препаратов в перечни на рассмотрение Комиссии выносятся все предложения, независимо от уровня оценки методического качества исследований. Вместе с тем, выводы исследований с низким методологическим качеством (для препаратов, не являющихся орфанными), не могут рассматриваться как достоверные, и не могут быть использованы при принятии решений. Аргументы для обсуждения в рамках Комиссии по включению препаратов в перечни, должны быть результатом качественных клинических и фармакоэкономических исследований.
Изменения в процедуре включения препаратов в перечни обусловлены необходимостью повышения качества подаваемой информации и достоверности данных результатов исследований лекарственных препаратов, предлагаемых для включения в перечни, а также учета особенностей орфанных препаратов, для чего для данных препаратов предлагается предоставить отдельный трек.
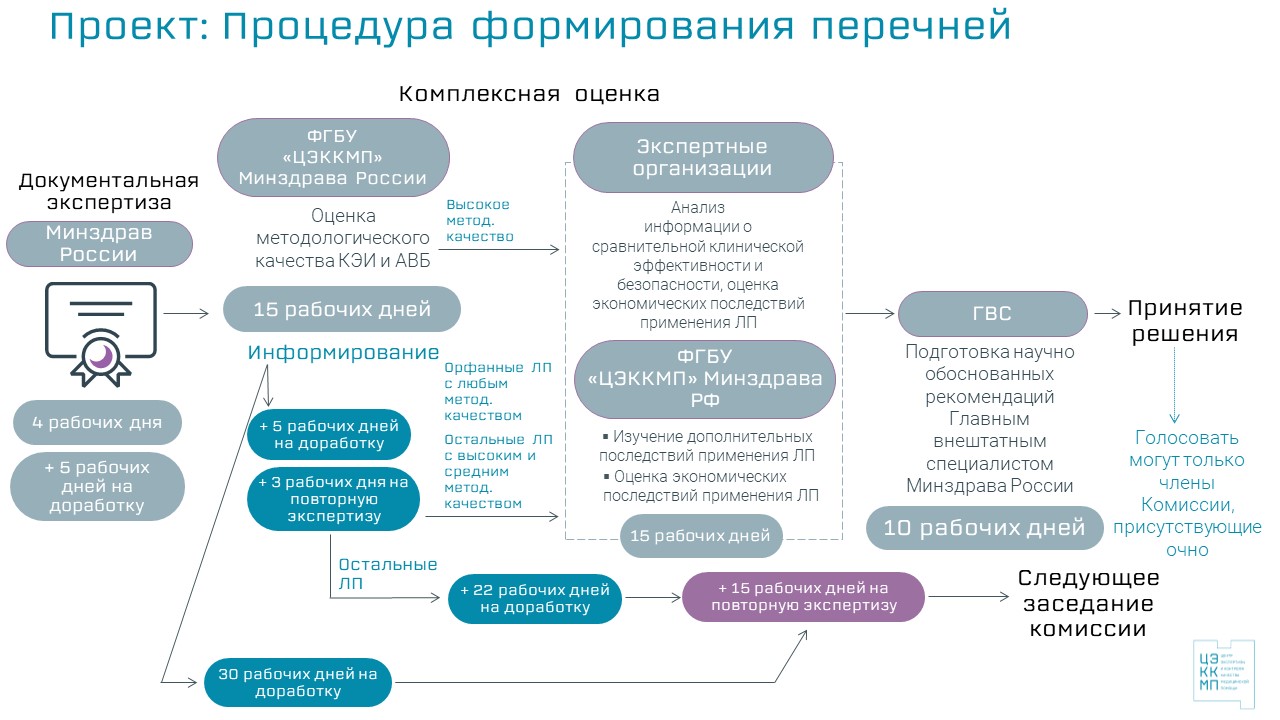
Для препаратов, не являющимися орфанными, на рассмотрение Комиссии предлагается выносить исключительно предложения с достоверными данными клинико-экономических исследований (КЭИ) и анализа влияния на бюджет (АВБ), т.е. высокой и средней оценкой методологического качества.
Следует отметить, что с одной стороны, количество заявок с адекватным качеством методологии исследований растет и в настоящее время достигает 50-60%. Вместе с тем, проведенный ФГБУ «ЦЭККМП» Минздрава России анализ поданных предложений на включение лекарственных препаратов в Перечни за период с 01.01.2021 по 11.05.2021 гг. показал наличие большого количества ошибок технического характера, которые могут влиять на общую оценку качества методологии исследования в рамках комплексной оценки. Так, для Перечня ЖНВЛП методологическое качество КЭИ могло быть улучшено в 36% случаев, АВБ – в 59% случаев, а для Перечня «14 ВЗН» методологическое качество АВБ могло быть улучшено в 100% случаев в случае своевременной корректировки.
Юлия Рыбченко, руководитель отдела методологического обеспечения проведения комплексной оценки технологий в здравоохранении ФГБУ «ЦЭККМП» Минздрава России представила проект изменений в Процедуре и методологии комплексной оценки лекарственных препаратов для включения Перечни на Совещании рабочей группы, которая состоялась 11.11.2022, при участии представителей отраслевых организаций – Международной ассоциации фармацевтических производителей (AIPM), Ассоциации российских фармацевтических производителей (АРФП) и др.
Проект: основные изменения в Процедуре
Предлагаемые изменения предусматривают предоставление возможности заявителям внесения необходимых доработок в КЭИ и АВБ низкого и среднего методологического качества в соответствии с комментариями к не соблюденным требованиям методологического качества, предоставляемыми в заключении ФГБУ «ЦЭККМП» Минздрава России. Срок доработки досье заявитель выбирает по своему усмотрению:
- Опция 1: 5 рабочих дней на доработку досье + 3 рабочих дня на повторную экспертизу, с возможностью последующей доработки досье в течение 22 дней.
- Опция 2: 30 рабочих дней на доработку досье.
После доработки предложения проходят второй этап экспертизы (в течение 15 рабочих дней), по результатам которой предложения с высокой и средней оценкой методологического качества в рамках хотя бы одного показания досье направляется на следующий этап оценки в рамках общей процедуры следующего квартала.
Проект: основные изменения методологии оценки качества исследований
Планируется введение дополнительного параметра оценки эффективности ЛП – «годы качественной жизни» (QALY, Quality Adjusted Life Years). Данный показатель позволяет оценить влияние медицинской технологии как на продолжительность, так и на качество жизни пациента и является международным стандартом.
Кроме того, планируется предоставление заявителям дополнительной возможности сравнения инкрементального показателя «затраты-эффективность» (Incremental Cost-Effectiveness Ratio, ICER) на год сохраненной качественной жизни с порогом готовности платить (ПГП), равным 3 ВВП (внутренний валовый продукт) на душу населения. ICER отражает дополнительную стоимость дополнительной единицы эффективности.
В текущей версии Постановления Правительства РФ № 871 расчет ICER необходим в случае если клиническая эффективность предлагаемого ЛП статистически значимо выше эффективности ЛП сравнения, но затраты на его применение выше, чем у ЛП сравнения. В таком случае необходим расчет не только ICER для предлагаемого рассматриваемого, но и для ЛП сравнения (референтный ICER), что ведет к дополнительным сложностям как для заявителя, так и для экспертных организаций. Фактически приходится проводить исследования двух препаратов (предлагаемого и сравнения).
В зарубежных странах используется иной подход: проводят сравнение с определенным пороговым значением ICER, выше которого препарат считается экономически неэффективным, поскольку дополнительные затраты на дополнительную единицу эффективности являются слишком высокими.
Планируемое нововведение позволит расширить возможные опции сравнения для предлагаемого к включению в перечни ЛП, не ограничивая использование привычных для сравнения опций.
.png)