Непрямые сравнения
- Методология /
-
6339
Метаанализ является аналитической частью систематических обзоров РКИ по сравнительной оценке эффективности и безопасности ЛП. Однако часто полученных в РКИ данных недостаточно для принятия решения в пользу того или иного ЛП. Можно найти этому законные объяснения. Так, целью большинства РКИ является получение доказательств эффективности и безопасности новых ЛП для дальнейшей регистрации, поэтому в качестве препарата сравнения обычно используется плацебо, отсутствие лечения (часто – на фоне стандартной терапии) [1] или сравниваются лишь два препарата, тогда как в действительности ЛП для лечения больных с определённой нозологией бывает больше двух, и в этом случае предметом интереса может быть такое сравнение, которое не проводилось в прямых («лоб в лоб», англ. head-to-head) клинических испытаниях [2]. Кроме того, до сих пор чаще всего новый ЛП сравнивается в клинических испытаниях с плацебо или со стандартной терапией, тогда как сопоставление его эффекта с конкурентом проводится не так часто, как это необходимо по вполне понятным причинам: практически все клинические испытания ЛП спонсируются их производителями, незаинтересованными в сравнении с потенциально конкурирующим продуктом [2]. Фармацевтические компании выступают заказчиками или участвуют в финансировании практически каждого влиятельного РКИ, и каждая компания разрабатывает свои Планы исследования и Протоколы, преследуя единственную цель: убедиться, что максимальное число их продуктов получит регистрационное удостоверение на самое широкое применение при максимальном числе показаний. Это значит, что фармацевтические компании стараются не спонсировать исследования, в которых проводится сравнение их препарата со схожими ЛП своих конкурентов [3].
Выходом из ситуации с отсутствием прямых сравнительных РКИ (англ. direct treatment comparison) могут быть непрямые сравнения (англ. indirect treatment comparison), которые предоставляют полезную информацию о разнице в эффекте между конкурирующими ЛП (которая в противном случае просто отсутствовала) с целью выбрать наилучший ЛП. Например, если два конкретных ЛП никогда не сравнивали между собой напрямую, но имело место сравнение их с общим препаратом сравнения (или плацебо), то непрямое сравнение может использовать относительные эффекты этих методов по отношению к общему ЛП сравнения. Важно также отметить, что чаще всего непрямые исследования проводят с данными РКИ для получения сравнительной действенности [1].
В 2017 году вышли Методические рекомендации ФГБУ «ЦЭККМП» Минздрава России по проведению непрямых сравнений лекарственных препаратов [4], в которых сказано, что в иерархии исследований в зависимости от их дизайна непрямое сравнение занимает промежуточное положение между РКИ и нерандомизированными сравнительными исследованиями, что соответствует уровню доказательности III.
Непрямые сравнения целесообразно выполнять в случаях, когда по итогам выполненного систематического поиска отсутствуют опубликованные результаты прямых сравнительных исследований ЛП и сравниваемых альтернатив [4].
Непрямое сравнение (наряду со смешанным сравнением) является одним из вариантов сетевого метаанализа, являющегося очередным методом синтеза доказательств в случае отсутствия прямых сравнительных исследований между двумя или более ЛП [4].
Некорректные методы непрямого сравнения
В настоящее время при отсутствии прямых сравнительных клинических исследований ЛП на практике часто используется простое сопоставление абсолютных значений эффектов ЛП, полученных в разных РКИ. Однако такой подход является некорректным, так как лишает РКИ их главного преимущества – рандомизации (англ. randomization) – случайного отнесения испытуемых к группам, например для экспериментальных или контрольных схем лечения. В пределах случайной изменчивости рандомизация участников должна сделать контрольные и экспериментальные группы сходными в начале исследования и гарантировать, что личные суждения и предвзятость исследователя не влияют на отнесение к группам.
Получаемый в любом РКИ результат всегда является относительным (по отношению к контролю – плацебо, стандартной терапии и т. д.) и представляет собой сумму специфического и неспецифических эффектов [2]. Для сохранения рандомизации в каждом исследовании необходимо сравнивать относительные эффекты (более подробно они будут рассмотрены ниже).
Построение сравнения, использующее только лишь данные из групп, получающих сравниваемые ЛП, и опускающее данные из группы плацебо, называют наивным непрямым сравнением (англ. naive indirect comparison) или нескорректированным непрямым сравнением (англ. unadjusted indirect comparison). Таких сравнений следует избегать, так как они ведут к ошибкам в результатах. Это объясняется следующими серьёзными недостатками такого сравнения [5].
Во-первых, эффект лечения, наблюдаемый в каждой отдельно взятой группе в ходе РКИ, имеет специфическую и неспецифическую составляющие. Специфическая часть является эффектом непосредственно от лечения, тогда как неспецифическая может включать в себя эффект естественного течения заболевания, эффект времени, эффект Хоторна, плацебо-эффект и так далее. Именно для выделения специфической составляющей эффекта в исследованиях применяется сравнение с группой контроля [5].
Хоторнский эффект (англ. Hawthorne effect) – это условия, в которых новизна, интерес к эксперименту или повышенное внимание к данному вопросу приводят к искажённому, зачастую слишком благоприятному результату. Участники эксперимента действуют иначе, более усердно, чем обычно, только благодаря осознанию того, что они причастны к эксперименту.
Поскольку в нескорректированном непрямом сравнении используются абсолютные значения величины эффекта из групп, взятых из разных исследований, то есть специфические составляющие эффекта не выделены, то оно не позволяет определить и специфическую составляющую различий между препаратами [5].
Во-вторых, игнорируется влияние случайности на наблюдаемые различия, которые должны быть оценены при помощи статистических методов [5].
Также является некорректным методом непрямого сравнения – арифметическое сравнение разностей величин эффекта в экспериментальных группах и соответствующих им группах контроля. На первый взгляд, данный способ позволяет учесть неспецифические эффекты, наблюдаемые как в экспериментальной группе, так и в группе контроля. Однако группы контроля в двух РКИ могут быть несопоставимы, и величины эффекта в этих группах могут существенно различаться, например из-за разной выраженности неспецифических эффектов, а это при таком способе сравнения не учитывается. Таким образом, при данном подходе игнорируется само наличие неспецифических эффектов и разница в их величинах в двух РКИ, а кроме того игнорируется и влияние случайности [5].
Ещё одним некорректным методом непрямого сравнения является так называемое неформальное непрямое сравнение (англ. informal indirect comparison). Оно заключается в арифметическом сравнении точечных оценок относительных эффектов препаратов, полученных в разных исследованиях. При таком способе непрямого сравнения также нивелируется проблема неспецифических эффектов и несколько нивелируется проблема различия групп контроля, однако по-прежнему игнорируется влияние случайности [5].
Различия между непрямыми сравнениями, смешанными сравнениями и сетевыми метаанализами
На рис. 1 показана сеть возрастающей сложности, в которой несколько методов лечения сравнивали между собой. Каждый узел отражал лечение, при этом линия, соединяющая два узла, отражала одно или несколько РКИ (с данными эффективности). Для любого лечения в рассматриваемой сети можно оценить относительный эффект в сравнении с другим вмешательством [5].
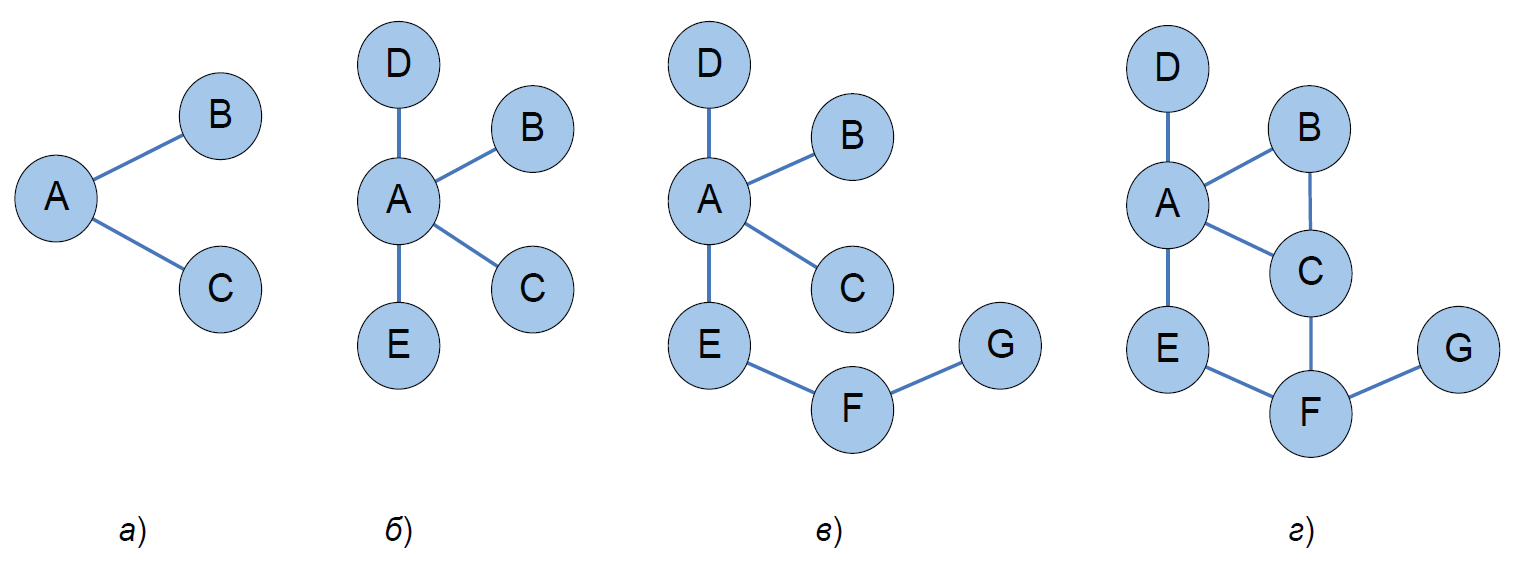
Рис. 1. Различные варианты непрямых сравнений
Примечание: сплошные линии указывают на наличие прямых сравнений между соответствующими лекарственными препаратами; а) непрямое сравнение; б) сетевой метаанализ; в) множественные непрямые сравнения; г) смешанные сравнения.
Предположим, что основной интерес представляет собой сравнение препаратов С и В, но при этом никаких прямых сравнений этих ЛП между собой не производили. В первой сети (см. рис. 1а) препарат В сравнивали с препаратом А в исследовании В-А, а препарат С сравнивали с препаратом А в исследовании С-А, так что непрямое сравнение позволяет оценить относительный эффект метода С относительно метода В. Непрямое сравнение препаратов С и В «привязано» к препарату А (имеет общий контроль), поэтому обозначается термином «контролируемое непрямое сравнение» (англ. adjusted indirect treatment comparison или методика Bucher [6]). Препарат А может представлять собой как активный контроль, так и плацебо. Ключевым моментом является сохранение рандомизации исследования. Например, если A, B и С – препараты лечения пациентов, ошибочным будет являться простое сравнение доли пациентов, ответивших на лечение препаратом В в исследовании пары А-В, и доли пациентов, ответивших на лечение лекарственным средством С в исследовании пары А-С. С использованием данных таким образом, могут возникнуть трудности в отделении действенности ЛП от эффекта плацебо [5].
Также различия в эффекте могут говорить о различных базовых рисках, даже там, где относительный риск согласуется между исследованиями, что является ещё одной причиной соблюдения рандомизации [5].
При контролируемом непрямом сравнении вычисляется относительный эффект двух интересующих ЛП по относительным эффектам препаратов, полученным в отдельных РКИ при сравнении с контрольными вмешательствами, и учитываются вариабельности величин эффектов. Для оценки вариабельности применяются методы аналитической статистики – расчёт доверительного интервала (ДИ) для величины относительного эффекта, тестирование статистической гипотезы. Важно подчеркнуть, что ни один из способов непрямого сравнения не позволяет нивелировать проблемы исходной несопоставимости популяций в двух исследованиях и неизбежных различий в лечении, применяемом в группах контроля [7].
Вторая сеть (рис. 1б) позволяет провести непрямое сравнение препаратов B, C, D и Е, привязанных к общему препарату сравнения А. Так как все рассматриваемые методы лечения связаны в сеть (то есть каждая пара имеет путь, связывающий методы внутри пары между собой), может быть проведено непрямое сравнение препаратов С и В, препаратов D и В, препаратов E и В, препаратов D и С, препаратов E и С, а также препаратов E и D. Такой анализ можно рассматривать как сетевой метаанализ [5].
В третьей сети (рис. 1в) не все исследования имеют общий препарат сравнения, но все методы лечения по-прежнему связаны. Препарат G через F связан с препаратами A, B, C, D и E посредством исследований пары E-F и пары F-G, так что возможно непрямое сравнение каждого метода лечения с любым другим из рассматриваемой сети. При этом следует отметить, что более опосредованные сравнения будут иметь меньшую точность [5].
Последняя сеть (рис. 1г) включает в себя как прямые, так и непрямые возможные сравнения – так называемые смешанные сравнения (англ. mixed treatment comparison) для стратегий лечения препаратами A, B и С. При этом стратегии A, C, E, F образуют другую, более длинную петлю. Для сетей, которые содержат петли, важно, чтобы результаты непрямых сравнений соответствовали результатам прямых сравнений [5].
Следует отметить, что проведение непрямого сравнения возможно также и в более сложных случаях, при наличии более трёх препаратов сравнения и отсутствии прямых сравнений между ними (рис. 1в и 1г). В таких случаях речь может идти о множественных непрямых сравнениях [5].
Независимо от структуры сети, парные сравнения, будь то прямые или непрямые сравнения, возможны только между стратегиями лечения, между которыми существуют связи [5].
Термины «смешанные сравнения», «множественные непрямые сравнения» и «сетевой метаанализ» иногда используются в литературе как синонимы. Если сеть содержит хотя бы одну петлю, чаще всего употребляют термин «смешанные сравнения»; при наличии разомкнутой сети – «непрямые сравнения»; «сетевой метаанализ» обычно используется в случае рассмотрения более двух РКИ, связывающих более двух стратегий лечения [5].
Таким образом, даже при отсутствии прямых сравнительных РКИ ЛП методика непрямого сравнения позволяет синтезировать необходимые доказательства, обладающие не меньшей, а в определённых ситуациях даже большей достоверностью [5].
Цель непрямого сравнения
Цель выполнения непрямого сравнения – это получение доказательств сравнительной клинической эффективности и/или безопасности двух и более альтернативных ЛП в тех случаях, когда отсутствуют прямые сравнительные исследования этих ЛП [4].
Основные этапы непрямого сравнения
Проведение синтеза доказательств путём непрямого сравнения должно основываться на систематическом обзоре [4]. Этапы проведения непрямого сравнения в целом аналогичны таковым при проведении систематического обзора с метаанализом. Также, по аналогии с метаанализом, очевидно, что необходимо оценивать достоверность результатов, используемых для непрямого сравнения РКИ [7]. Можно выделить 12 необходимых этапов проведения непрямого исследования:
- Выдвижение гипотезы исследования.
- Формулирование критериев включения РКИ или метаанализов РКИ в непрямое сравнение и исключения из него, сведений о:
- популяции (название патологии или клинического состояния, стадия или тяжесть течения заболевания, наличие или отсутствие сопутствующих заболеваний, пол, возраст);
- исследуемом ЛП (международное непатентованное наименование, торговое наименование, лекарственная форма, способ введения, дозировка, показания к применению, специфические условия применения);
- препарате сравнения (аналогично);
- изучаемых исходах (критериях эффективности или безопасности). - Систематический поиск и отбор РКИ или метаанализов РКИ.
- Проверка возможности построить сеть доказательств для непрямого сравнения, в том числе анализ принятых допущений для непрямого сравнения, так как данная методика синтеза доказательств позволяет получать достоверные результаты только при обоснованности принятых допущений.
- Оценка методологического качества каждого РКИ.
- Формирование совокупности исследований, подлежащих дальнейшему анализу, в результате применения критериев включения и исключения исследований.
- При наличии двух и более РКИ, оценивающих один из ЛП, включённых в сеть доказательств непрямого сравнения с общим контролем, – проведение метаанализа таких РКИ с учётом правил их проведения.
- Анализ гетерогенности включённых РКИ или метаанализов РКИ. При этом определяют:
- методологическую гетерогенность: дизайн, методологическое качество РКИ;
- клиническую гетерогенность;
- сопоставимость характеристик популяций в исследованиях (пол, возраст, тяжесть и стадия заболевания и др.). Если не вполне соответствуют, то с помощью критериев согласия (критерий χ2) оценивают, могут ли влиять различия в популяциях на абсолютную или относительную величину эффекта;
- сопоставимость характеристик лечения в исследованиях (дозы, режимы введения ЛП);
- сопоставимость характеристик общего контроля в исследованиях;
- статистическую гетерогенность;
- в случае включения метаанализов – используются ли в них одинаковые модели (модели со случайными или фиксированными эффектами) и прочее. - Проведение собственно непрямого сравнения.
- Анализ чувствительности результатов.
- Формирование выводов по результатам выполненного непрямого сравнения.
- Интерпретация результатов и подготовка Отчёта.
Допущение транзитивности
Ключевым для непрямого сравнения является допущение транзитивности (англ. transitivity assumption). Оно означает, что группы, имеющиеся в одних РКИ, используемых для построения сети доказательств, и отсутствующие в других, могли бы в них быть, а их отсутствие является случайным. Таким образом, необходимо оценить потенциальную возможность того, что все группы (включая группы контроля) могли бы существовать в рамках одного РКИ, иначе говоря, они транзитивны, то есть могут быть перенесены из одного исследования в другое. В литературе это допущение нередко обозначается как допущение подобия (англ. similarity assumption), что не вполне точно, поскольку акцентирует внимание на сходстве отдельных характеристик групп. В действительности степень сходства изначальных характеристик групп может не иметь значения, если признаки, по которым эти группы различаются, не влияют на величину изучаемого эффекта, то есть не являются модификаторами эффекта [7].
Разберём суть допущения транзитивности более подробно. В первую очередь, транзитивность касается характеристик используемого общего контроля. Он должен быть идентичным во всех исследованиях, участвующих в построении сети доказательств (рис. 2). Это означает, что эффект от применения контроля (препарата сравнения) должен быть одинаковым (допускается лишь случайная вариабельность). При этом недостаточно ограничиваться лишь идентичностью наименований назначаемых ЛП в контрольной группе, следует оценивать режимы применения общего контроля (доза, кратность введения, путь введения и т. д.) и их возможное влияние на производимый эффект [7].
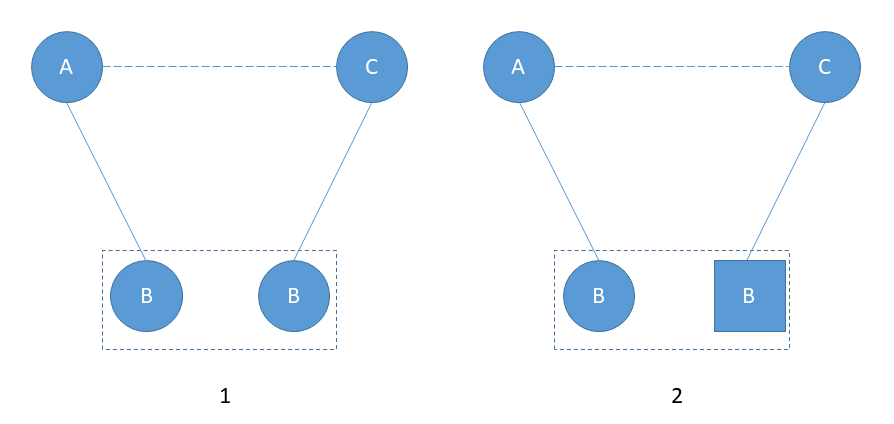
Рис. 2. Допущение транзитивности
Примечания: 1 – транзитивность имеет место; 2 – транзитивность отсутствует.
Подобный подход должен сохраняться даже в том случае, если в качестве общего контроля выступает плацебо. Величину плацебо-эффекта может определять и путь введения препарата, так что в случае использования неодинаковых путей введения допущение транзитивности не соблюдается [7].
Второй ключевой аспект допущения транзитивности связан с различиями исходных характеристик выборок пациентов, участвовавших в РКИ. С этим сопряжены основные трудности при проведении непрямого сравнения. Очевидно, что популяции пациентов в используемых исследованиях должны быть идентичными, сравниваемые методы лечения должны иметь одинаковые показания [7].
Однако даже если исследования проведены в одной и той же популяции, вполне вероятно, что исходные характеристики групп всё же будут различаться. Допущение транзитивности подразумевает, что все известные или потенциальные модификаторы эффекта имеют одинаковое распределение в группах сравнения и при этом оказывают одинаковое влияние на величину эффекта. Очевидно, что для подобной оценки транзитивности необходимо иметь результаты анализа влияния модификаторов эффекта. К сожалению, далеко не всегда эти сведения приводятся в публикациях результатов исследований. Вдобавок нужно также иметь представление о возможных модификаторах эффекта, что требует участия специалиста в конкретной области клинической медицины. Всё это делает проверку допущения транзитивности довольно сложной. Проблема может быть ещё серьёзнее, если исследования были проведены с большим разрывом во времени (например, новый и старый ЛП), поскольку многие факторы с течением времени меняются (имеет место историческое смещение) [7].
Из-за необходимости соблюдения транзитивности для проведения непрямых сравнений можно использовать только РКИ или метаанализы РКИ.
Методика проведения непрямого сравнения
Для получения научно обоснованных оценок сравнительной эффективности ЛП при отсутствии прямых сравнительных клинических исследований предложена методика их непрямого сравнения относительно общего для них контроля. При непрямом сравнении требуется, чтобы используемые для непрямого сравнения РКИ или метаанализы РКИ обладали равной достоверностью и обобщаемостью. Именно решение этих вопросов является самым сложным при проведении непрямого сравнения [2].
В случае отсутствия в доказательной базе предлагаемого к включению ЛП и/или альтернативного препарата сравнительных исследований – рекомендуется оценить возможность выполнения скорректированного непрямого сравнения (англ. matching adjusted indirect comparison) [4]. Скорректированные непрямые сравнения представляют собой статистическое сравнение эффекта двух и более ЛП относительно общего для них контроля. Таким общим контролем может быть как плацебо (чаще всего), так и стандартная, или базисная, терапия (профилактика или диагностика).
Скорректированное непрямое сравнение по исходам, основанным на бинарных данных (например, частота достижения ответа на терапию, частота возникновения нежелательного явления и прочего), выполняется с использованием информации о точечной величине меры эффекта и её ДИ в прямых сравнительных исследованиях А-B и A-C (см. рис. 1а), что затем позволяет рассчитать относительный эффект и ДИ для сравнения B-C – то есть выполнить непрямое сравнение. Такими относительными эффектами могут быть относительный риск, отношение шансов – в зависимости от оцениваемого исхода (критерия эффективности или безопасности) [4].
Результаты скорректированного непрямого сравнения для бинарных исходов с использованием относительного риска (ОР, англ. relative risk (RR)) – то есть отношения частоты события в группе лечения к частоте события в группе контроля – рассчитываются по следующей формуле:

В случае отсутствия данных о точечной мере эффекта и её ДИ в прямых сравнительных РКИ или метаанализе РКИ, включённом в сеть доказательств непрямого сравнения, такие данные можно рассчитать, если в публикациях по результатам прямых сравнительных исследований доступна информация о количестве пациентов с альтернативными значениями оцениваемого исхода в каждой из групп сравнения (n1, n2 и так далее) и общем количестве пациентов в каждой группе сравнения (N1, N2 и так далее).
Важно обратить внимание, что при непрямом сравнении двух и более ЛП результаты могут зависеть от того, какой показатель оценивали (RR или OR). Например, при сравнении с плацебо препарат В может быть предпочтительнее С при оценивании показателя RR, но в то же время С может быть предпочтительнее В при оценивании через OR [5].
Скорректированное непрямое сравнение по исходам, основанным на непрерывных данных (например, средняя продолжительность госпитализации, средняя продолжительность симптомов и прочего). Следует отметить, что скорректированное непрямое сравнение по исходам, основанным на непрерывных данных, возможно только при условии нормального распределения изучаемого признака в каждой из групп сравнения во всех включённых исследованиях, поскольку расчёт средних применяется только для признаков с нормальным распределением. Таким образом, в случае если непрямое сравнение выполняется по исходу, основанному на непрерывных данных, рекомендуется перед выполнением непрямого сравнения убедиться, что в каждом из исследований, включённых в сеть доказательств непрямого сравнения, признаки соответствуют закону нормального распределения (данное обстоятельство должно быть обосновано (доказано) в каждом из исследований на основании проверки соответствующих статистических гипотез) [4].
Для выполнения непрямого сравнения по исходам, основанным на непрерывных данных, необходимо использовать такую меру исхода, как разность средних (РС) и её ДИ. Выполнение непрямого сравнения по исходам, основанным на непрерывных данных, может потребовать дополнительных расчётов, если в публикации о РКИ не приведён ДИ для РС (при наличии в тексте публикации об исследовании необходимых для проведения непрямого сравнения данных) [4].
Дополнительные расчёты выполняются при необходимости отдельно для каждого исследования, включённого в непрямое сравнение, то есть РС и её ДИ вычисляется для каждого из прямых сравнений отдельно [4].
В случае если в публикации об исследовании не приведён 95 % ДИ для РС, необходимо выполнить расчёт ДИ для РС согласно следующей формуле:
ДИ=[∆MD-1,96∆m; ∆MD+1,96∆m], где
ΔMD – разность средних;
Δm – стандартная ошибка среднего для разности средних.
В случае если в тексте публикации для одного РКИ не приведена мера исхода РС, однако приведены средние (М), РС вычисляется как разность средних значений [4].
В случае если в тексте публикации об исследовании не приведена информация о стандартной ошибке среднего для РС, для выполнения непрямого сравнения необходимо выполнить дополнительные расчёты стандартной ошибки среднего для РС [4]:

В случае если в тексте публикации об исследовании не доступна информация ни о СКО, ни о стандартной ошибке среднего отдельно для каждой из групп сравнения, выполнение непрямого сравнения с использованием данного исследования не будет являться возможным [4].
После выполнения дополнительных расчётов для каждого из исследований, включённых в сеть доказательств непрямого сравнения (при необходимости), возможно выполнение непосредственно непрямого сравнения изучаемых ЛП. Результаты скорректированного непрямого сравнения для исходов, основанных на непрерывных данных, рассчитываются по следующей формуле [4]:
PCBC=PCAC - PCAB, где
РС – разность средних.
Следует отметить, что в случае, если в одном РКИ, включённом в сеть доказательств, РС рассчитывается как разность средних препарата B и общего препарата сравнения A, а в другом РКИ, включённом в сеть доказательств, РС рассчитывается как разность средних для препарата С и общего препарата сравнения A, следует выполнить дополнительные расчёты, при которых во втором РКИ РС будет рассчитываться как разность средних для препарата В и препарата С (рис. 1). Такие расчёты являются возможными только в случае, если в тексте публикации о РКИ приведены средние значения (М) показателей по исходам, основанным на непрерывных данных [4].
Следует также отметить, что в случае, если в публикации об исследованиях для оценки исхода на основании непрерывных данных используется мера исхода, отличная от средних (М) или РС, а также не приведён хотя бы один из параметров: ДИ, СКО, стандартная ошибка среднего (для РС или для каждого из средних значений (М) в каждой из групп сравнения), количество пациентов в каждой из групп сравнения, – выполнение скорректированного непрямого сравнения с использованием данного исследования не представляется возможным [4].
Скорректированное непрямое сравнение по исходам, основанным на анализе времени до наступления события – это статистические процедуры для анализа времени между точкой включения участника в исследование и определённым изучаемым исходом (например, общая выживаемость, выживаемость без прогрессирования, бессобытийная выживаемость).
Скорректированное непрямое сравнение по исходам выполняется с использованием информации о точечной величине меры эффекта и её ДИ в прямых сравнительных исследованиях А-С и А-B (рис. 1а), что затем позволяет рассчитать относительный эффект и ДИ для сравнения B-С – то есть выполнить непрямое сравнение. Таким относительным эффектом будет являться отношение угроз (ОУ, англ. hazard ratio (HR)) – это отношение величины угрозы в одной группе пациентов к величине угрозы в другой группе пациентов.
ОУ принимается постоянным в течение всего периода наблюдения. Как правило, данная мера исхода применяется при анализе времени до наступления события [4].
Результаты скорректированного непрямого сравнения для исходов, основанных на времени до наступления события, рассчитываются по следующей формуле:
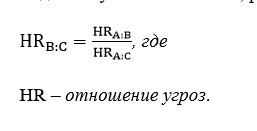
Следует отметить, что в случае, если в публикации об исследовании или дополнительных материалах к данной публикации не представлены точечные значения ОУ и его ДИ, использование данного исследования для проведения непрямого сравнения не является возможным, поскольку для расчёта ОУ и его ДИ необходимы первичные данные исследования (продолжительность наблюдения и индикатор цензурирования для каждого пациента) [4].
Расчёт относительного эффекта. При проведении клинико-экономического анализа требуется, помимо оценки отношения шансов, вычисление относительного эффекта сравниваемых стратегий лечения. Основываясь на относительной разнице с общим препаратом сравнения, можно оценить эффективность каждого из ЛП с поправкой на группу общего препарата сравнения [1].
Среднюю эффективность для группы общего препарата сравнения рассчитывают как средневзвешенную эффективность групп плацебо по всем включённым РКИ с учётом числа пациентов в каждой группе. Данную величину рассматривают в качестве показателя эффекта в эталонной группе плацебо (RP) [1]. Далее можно оценить отношение шансов в группе плацебо (ORRP), вычисляемое по формуле:

Представление результатов непрямого сравнения
Результаты выполненного непрямого сравнения должны отражать [4]:
- схему непрямого сравнения с указанием прямых сравнительных РКИ или метаанализов РКИ, включённых в сеть доказательств непрямого сравнения, собственно непрямого сравнения, а также исхода, по которому выполняется непрямое сравнение;
- результаты всех прямых сравнительных РКИ или метаанализов РКИ (включая собственный метаанализ, если таковой был выполнен), вошедших в сеть доказательств непрямого сравнения с указанием меры исхода, её точечной оценки и ДИ, а также дизайна исследования, в котором получен результат;
- точечные оценки исхода и ДИ.
Интерпретация результатов непрямого сравнения
При интерпретации результатов непрямого сравнения учитывается мера эффекта, оцениваемая на основании точечной оценки эффекта и его ДИ (то есть направление эффекта) в зависимости от типа данных и того, является ли оцениваемый исход положительным или отрицательным для пациента [4].
_________
Источник: Включение лекарственных препаратов в ограничительные перечни: пошаговый алгоритм / под общ. ред. Белоусова Д. Ю., Зырянова С. К., Колбина А. С. — М. : Издательство ОКИ : Буки Веди, 2019. — 252 с. : ил. ISBN 978-5-4465-2555-3. https://clck.ru/MBP84
_________
Литература
- Балыкина Ю. Е., Колбин А. С. Использование непрямых сравнений при проведении фармакоэкономической экспертизы [Электронный ресурс] // Фармакоэкономика. – 2013. – Т. 6. – № 4. – С. 3–6. – Режим доступа: https://clck.ru/FFnXS
- Горяйнов С. В., Реброва О. Ю. Непрямые сравнения в оценке медицинских технологий [Электронный ресурс] // Педиатрическая фармакология. – 2012. – Т. 9. – № 2. – С. 6–9. – Режим доступа: https://clck.ru/FFnXs
- Ioannidis J. Meta-research: The art of getting it wrong [Электронный ресурс] // Res. Syn. Meth. – 2010. – № 1. – С. 169–184. – Режим доступа: https://clck.ru/FFnQt
- Методические рекомендации по проведению непрямых сравнений лекарственных препаратов. Утверждены приказом ФГБУ «ЦЭККМП» Минздрава России от 29.12.2017 № 181-од [Электронный ресурс]. – Режим доступа: https://clck.ru/ETmwS
- Основные понятия в оценке медицинских технологий : метод. пособие [Электронный ресурс] / под общ. ред. Колбина А. С., Зырянова С. К., Белоусова Д. Ю. – М. : Издательство ОКИ, 2013. – 42 с. : ил. – Режим доступа: https://clck.ru/FFnYK
- Bucher H. C., Gordon H. G., Lauren E. G., Walter S. D. The results of direct and indirect treatment comparisons in meta-analysis of randomized controlled trials [Электронный ресурс] // J Clin Epidemiol. – 1997. – V. 50. – № 6. – С. 683–691. – Режим доступа: https://clck.ru/FFnZu
- Реброва О. Ю., Горяйнов С. В. Непрямые и смешанные сравнения медицинских технологий, сетевой метаанализ [Электронный ресурс] // Медицинские технологии. Оценка и выбор. – 2013. – № 4. – С. 8–14. – Режим доступа: https://clck.ru/FFnZ3
.png)
